Содержание
- 1 Введение
- 2 Область применения
- 3 Принципы анализа рисков
- 4 Основное содержание процесса анализа рисков
- 5 Методы анализа риска
- 6 Интеграция методов анализа риска в промышленность и систему надзора
- 7 Определения
- 8 Библиография
- 9 Приложение I. Методы анализа рисков
- 10 Приложение II. Области применения методов анализа рисков
- 11 II.6 Анализ рисков как часть производства
- 12 II.7 Анализ рисков как часть лабораторного контроля и контроля ста- бильности
Введение
Принципы анализа рисков успешно используются во многих областях бизнеса и работе правительственных организаций, включая финансы, страхование, профессиональной безопасности, обеспечения здоровья, безопасности в фармации, а также органами надзора в этих областях. Несмотря на то, что есть некоторые примеры использования методов анализа рисков в фармацевтической промышленности, они носят ограниченный характер и охватывают все средства, относящиеся к анализу рисков. Более того, в фармацевтической промышленности большую роль играют системы качества и становится очевидным, что анализ рисков является важным элементом эффективности системы качества.
Под риском понимается комбинация вероятности ущерба и тяжести этого ущерба. Однако достичь понимания о применении анализа риска между различны- ми участвующими сторонами трудно, поскольку каждая сторона может иметь свое понимание потенциального ущерба, приписывать различную вероятность и тяжесть различным видам ущерба.
Несмотря на то, что к лекарственным средствам имеют отношение различные стороны, включая потребителей, врачей, представителей власти и промышленности, важнейшим фактором является защита потребителя путем снижения риска для ка- чества.
В производстве и применении лекарственных средств и их компонентов всегда присутствует некоторая степень риска. Риск для качества продукции является лишь одной из составляющих общего риска. Важно понимать, что качество продукции должно обеспечиваться в течение всего цикла жизни продукции так, чтобы основ- ные свойства лекарственного средства оставались теми же, что были при клиниче- ских испытаниях. Эффективное применение метода анализа рисков может обеспе- чить высокое качество лекарственного средства, потребляемого пациентом, за счет предупредительных мер по обнаружению и устранению потенциальной угрозы для качества при разработке и производстве. Более того, использование методов анализа рисков позволяет принимать лучшие и обоснованные решения, может дать надзор- ным органам более веские основания о способности предприятия справиться с по- тенциальными рисками и может снизить вероятность пропуска упущений надзор- ным органом с учетом продолжительности и серьезности этих упущений.
Настоящий документ дает систематизированный подход к анализу риска для качества. Он является отправным документом, независимым от других документов ICH по качеству, но поддерживающих стандарты и правила для фармацевтической промышленности или надзорных органов. Он дает специализированное руководство по принципам и средствам анализа риска для качества, которые могут способство- вать принятию более эффективных и последовательных решений как для надзорных органов, та и для промышленности в отношении субстанций и готовых лекарствен- ных средств в течение их цикла жизни. Оно не вносит нового в существующие требования, устанавливаемые надзорными органами.
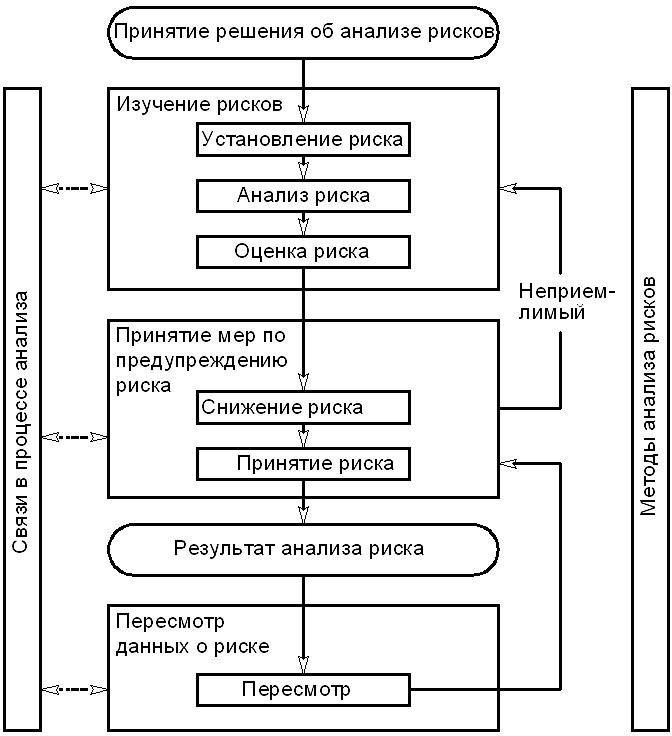
Рис. 1 Типовая схема процесса анализа рисков
Использование формальных методов анализа рисков (общепринятых методов и/или внутренних инструкций) не всегда целесообразно и не всегда необходимо. Допускается использовать неформальные методы на основе эмпирических методов или внутренних инструкций. Применение методов анализа рисков может облегчить выполнение, но не снимает обязанности производителя соответствовать норматив- ным требованиям и не заменяет необходимого взаимодействия между производителем и надзорными органами.
Область применения
Настоящее руководство устанавливает принципы и дает примеры использования методов анализа рисков в применении к различным этапам обеспечения качества лекарственных средств. К этим этапам относятся разработка, производство, распределение (поставка), инспектирование и внесение изменений в процессы на протяжении всего жизненного цикла производства субстанций, готовых лекарственных
средств, продуктов биологического и биотехнологического происхождения, включая использование сырья, растворителей, наполнителей, упаковочных материалов и материалов для маркировки.
Принципы анализа рисков
Существует два основных принципа анализа рисков:
- Оценка риска для качества должна основываться на научном подходе и направлена на защиту потребителя;
- Объем работы и подробность документального оформления при анализе рисков должны определяться степенью риска.
Основное содержание процесса анализа рисков
Анализ рисков является систематизированным процессом оценки, контроля, установления связей и пересмотров, связанных с риском для качества лекарственного средства в течение всего жизненного цикла. Схема анализа рисков показана на рис. 1. Могут использоваться и другие схемы. Значение каждого элемента схемы может отличаться для разных случаев, но каждый из них должен рассматриваться в той степени, которая определяется спецификой конкретного риска.
На схеме не показаны точки принятия решений, поскольку решение может быть принято в любой точке процесса. Решениями могут быть: возврат к предыдущему шагу и поиск новой информации, корректировка схемы анализа риска и даже завершение анализа риска, основываясь на полученных данных.
Примечание: Слово «неприемлемый» на схеме относится не только к нормативным или правовым требованиям, но также означает повторное проведение анализа рисков.
4.1 Ответственность
Анализ рисков, как правило, но не всегда, проводится группой специалистов различного профиля (например, службы качества, развития предприятия, производства, сбыта, маркетинга, инженерных, юридических служб, подразделений статистики и клинических испытаний) в дополнение лицам, имеющим подготовку в области анализа риска.
Лица, принимающие решения, должны:
- нести ответственность за координацию работы по анализу рисков различными подразделениями предприятия;
- обеспечить правильную постановку задачи анализа рисков, организовать работы по ее решению и привлечению необходимых ресурсов.
4.2 Начало работы по анализу рисков
Анализ риска включает в себя систематизированный процесс координации, облегчение и улучшение принятия решений в отношении рисков. Возможные действия при подготовке работы по анализу рисков включает следующее:
- Формирование проблемы и/или вопросов, предположений, связанных с рисками;
- Сбор исходных данных и/или данных о потенциальной опасности, ущербе или воздействии на здоровье человека, связанного с риском;
- Назначение руководителя группы и привлечение необходимых ресурсов;
- Установление сроков выполнения работы, лиц, которым должны быть представлены ее результаты и уровень лиц, принимающих решение в отношении анализа рисков.
4.3 Изучение рисков
Изучение рисков включает в себя установление опасностей, анализ и оценку рисков, связанных с этими опасностями (см. ниже). Изучение риска начинается с ясного описания проблемы или вопросов, связанных с риском. На основе этого определяется метод анализа риска (см. пример в разделе 5) и необходимая информация.
Для ясного определения рисков полезно ответить на три основных вопроса:
- Что может действовать неправильно (выйти за допустимые пределы)?
- Какова вероятность этого?
- Каковы последствия (тяжесть) этого?
Установление риска является процессом анализа информации по определению опасности, относящейся к данному риску или описание проблемы. Указанная ин- формация может включать предшествующие данные, теоретический анализ, мнения и данные об участии различных сторон. Установление риска отвечает на вопрос: что может действовать неправильно, включая обозначение возможных последствий.
Анализ риска является исследованием, связанным с определенными опасностями. Он состоит в количественной и качественной оценке вероятности ущерба и его тяжести. Некоторые методы анализа рисков учитывают возможность определить опасность.
Оценка риска состоит в сравнении полученных данных о риске с критериями риска. При оценке риска учитывается обоснованность ответов на все три вышеуказанных вопроса.
При выполнении анализа рисков важным условием является достоверность полученных данных. Четкое обозначение допущений и факторов неопределенности повышает достоверность анализа и/или позволяет оценить ее пределы. Неопределенность вызывается неполной информацией о процессе и его изменениях (предвиденных и непредвиденных). К типичным причинам неопределенности относятся недостаток информации, отсутствие научных проработок, неполное понимание
процесса, причин опасности (например, нарушений в процессе, причин нестабильности) и возможности формулирования проблемы.
Результатом изучения рисков является его количественная оценка или качественное описание риска. Количественная оценка риска выражается вероятностью риска. Вместо этой оценки может быть дано качественное определение «высокий»,
«средний» или «низкий», сопровождающиеся возможно более подробным описанием. Иногда дается цифровое ранжирование риска. При количественной оценке вероятность определенного последствия с учетом влияющих на риск факторов. Таким образом, количественная оценка риска полезна для одного конкретного последствия в определенное время. Существуют также методы относительной оценки риска, в которых сочетается несколько степеней ущерба и их вероятностей в итоговой оценке риска. На промежуточных этапах цифрового ранжирования может использоваться количественная оценка риска.
4.4 Меры по предупреждению риска
Меры по предупреждению риска включает в себя принятие решения о снижении и/или принятия данного значения риска. Целью предупреждения риска является его снижение до допустимого уровня. Затраты, связанные с принятием мер, должны быть пропорциональны степени риска. Лица, принимающие решения, могут использовать различные методы, включая анализ «полезный эффект – затраты», для понимания целесообразных мер по предупреждению риска.
При принятии мер по предупреждению риска следует ответить на вопросы:
- Выходит ли риск за допустимые пределы?
- Что может быть сделано для снижения или устранения риска?
- Каков приемлемый баланс между полезным эффектом, затратами и требуемыми ресурсами?
- Не появляются ли новые риски в результате принятия мер по уже установленным рискам?
Снижение риска направлено на уменьшение или устранение риска для качества, если он превышает заданные (допустимые) пределы (рис.1). Снижение риска может включать действия по уменьшению тяжести и вероятности ущерба. Действия по улучшению определения опасностей и рисков для качества. Принятие мер по снижению риска может привести к появлению новых рисков или увеличить значимость других существующих рисков. Целесообразно рассматривать работу по оценке рисков таким образом, чтобы обнаружить и оценить любые возможные изменения в отношении рисков после принятия мер по снижению риска.
Допущением риска является решение о допустимости риска. Принятие риска может быть решением о принятии остаточного риска или решением , в котором указано, что остаточный риск не задан. Для некоторых видов ущерба, даже лучшие методы анализа и предупреждения рисков могут не устранить риск полностью. В этих случаях следует признать, что были использованы соответствующие методы анализа рисков и риск для качества уменьшен до заданного (допустимого) уровня. Данный уровень зависит от многих факторов и должен устанавливаться исходя из конкретных обстоятельств.
4.5 Связи в процессе анализа рисков
Связи в процессе анализа рисков состоит в обмене информацией между лица- ми, принимающими решения и другими участниками работы. Стороны, которые могут участвовать в этом, показаны на рис. 1 стрелками с пунктиром. Связи устанавливаются между причастными сторонами, например, между надзорными органами и производителем, производителем и потребителем, внутри предприятия и пр. Пере- даваемая информация может относиться к существованию, природе, форме, вероятности, тяжести, приемлемости, мерам по предупреждению, устранению, обнаружению рисков или другим факторам. Необязательно устанавливать для каждого случая риска. Связь по принятию решений между промышленностью и надзорными органа- ми может осуществляться в установленном действующими документами порядке.
4.6 Рассмотрение данных о риске
Анализ рисков должен стать отправной точкой в процессе обеспечения качества. Следует ввести порядок рассмотрения или контроля событий.
Результаты анализа рисков следует рассматривать, чтобы учесть новые данные науки и практики. После начала процесса анализа рисков, его следует применять для случаев, которые могут оказать влияние на решения по анализу рисков для качества, независимо от того, являются ли эти решения плановыми (например, результаты анализа продукции, инспекции, аудитов, контроля измерений) или незапланированными (например, обнаружение причины при исследовании отклонений, отзывы продукции). Периодичность проведения рассмотрения зависит от степени риска. При рассмотрении рисков следует учитывать решения по допустимости риска (п. 4.4).
Методы анализа риска
Анализ рисков для качества дает научную и практическую поддержку при принятии решений. Он дает документально оформленные, прозрачные и воспроизводимые методы для выполнения процесса анализа рисков, основываясь имеющихся знаниях об оценке вероятности, тяжести и в отдельных случаях возможности обнаружения риска.
Оценка риска для качества выполнялась обычно различными неформальными методами (эмпирическими и/или по внутризаводским инструкциям), основываясь на основе, например, на наблюдениях, анализе тенденций или другой информации. Некоторые подходы по-прежнему позволяют получить полезную информацию на основе анализа рекламаций, дефектов качества, отклонений и наличием средств.
В дополнение к этому в фармацевтической промышленности и в надзорных органах могут использоваться известные методы анализа рисков и инструкции предприятий.
Ниже приведен неполный список этих методов (см. приложение А и раздел 8):
- Основные методы анализа рисков (диаграммы потоков, контрольные листы и пр.);
- Анализ вида и влияния отказов (Failure Mode Effects analysis – FMEA);
- Анализа вида, влияния и критичности отказов (Failure Mode, Effects and Crit- icality Analysis – FMECA);
- Анализ дерева отказов (Fault Tree Analysis — FTA);
- Анализ опасностей в критических контрольных точках (Hazard Analysis and Critical Control Points — HACCP);
- Анализ опасностей для эксплуатации (Hazard Operability Analysis — HAZOP);
- Предварительный анализ опасности (Preliminary Hazard Analysis — PHA);
- Ранжирование и отсеивание рисков (Risk ranking and filtering);
- Вспомогательные статистические методы (Supporting statistical tools).
Эти методы могут использоваться в специальных областях, относящихся к качеству субстанций и готовых лекарственных средств. В сочетании с ними могут использоваться методы анализа рисков и вспомогательные статистические методы (например, оценка вероятности риска). Это обеспечивает гибкость, способствующую применению методов анализа рисков.
Анализ рисков должен выполняться тщательно, в документальной форме, находиться на современном уровне знаний и соответствовать сложности и/или критичности рассматриваемой проблемы.
Интеграция методов анализа риска в промышленность и систему надзора
Анализ риска для качества, будучи введенным в систему обеспечения качества, способствует принятию практичных и обоснованных решений (приложение II). Как было подчеркнуто во введении, применение методов анализа рисков не снижает обязательств предприятий выполнять установленные требования. Однако эффективное применение методов анализа рисков может способствовать принятию более обоснованных решений, обеспечить надзорные органы большей уверенностью в способности предприятия справиться с потенциальными рисками и может влиять на объем и уровень незамеченных надзорным органом упущений. В дополнение к этому анализ рисков позволяет лучше использовать ресурсы всех сторон.
Обучение работников предприятий и надзорных органов методам анализа рисков позволяет лучше понять процесс принятия решений и закладывает уверенность в результатах работы по анализу рисков.
Методы анализа рисков должны быть включены в существующую практику и документы. В приложении II приведены примеры использования методов анализа рисков в производстве лекарственных средств. Эти примеры даны только для иллюстрации и не являются исчерпывающими или к чему-то обязывающими. Эти приме- ры не вводят новых требований по сравнению с существующими нормативными документами.
Примеры для предприятий и надзорных органов (приложение II):
- Обеспечение качества.
Примеры для работы предприятий (приложение II):
- Развитие,
- Помещения, оборудование и технологические среды,
- Обращение с материалами,
- Производство,
- Контрольные лаборатории и контроль стабильности,
- Упаковка и маркировка.
Примеры для надзорных органов (приложение II):
- Инспектирование и оценка деятельности.
До тех пор, пока деятельность надзорных органов будет носить региональный характер, единое понимание и применение методов анализа рисков может способствовать взаимному доверию и принятию согласованных решений различными органами для одних и тех же исходной информации. Это сотрудничество может иметь важное значение для формирования политики и руководств, которые объединяют и поддерживают деятельность по анализу рисков.
Определения
Лицо, принимающее решение (Decision maker): Лицо, компетентное и имеющее право принятия соответствующих и своевременных решений в отношении анализа рисков.
Выявляемость (Detectability): Способность к обнаружению опасности.
Ущерб (Harm): Нанесение вреда здоровью, в том числе из-за утраты лекарственным средством своих свойств или отсутствия лекарственного средства в наличии.
Опасность (Hazard): потенциальный источник ущерба (руководство ИСО/МЭК 51).
Жизненный цикл продукта (Product Lifecycle): все этапы жизни продукта от начала разработки, включая поставку на рынок, до прекращения существования продукта.
Качество (Quality): степень соответствия свойств продукта, системы или процесса заданным требованиям (см. определение качества в ICH Q6a для субстанций и лекарственных средств).
См. также определение качества в ГОСТ Р 52537-2006.
Анализ риска для качества (Quality risk management): систематизированный процесс оценки, принятия мер, связи и пересмотра в отношении качества лекарственного средства в течение его жизненного цикла.
Система обеспечения качества (Quality system): совокупность всех факто- ров, обеспечивающих реализацию политики в области качества и направленных на соответствие требованиям качества.
См. также определение системы обеспечения качества в ГОСТ Р 52537-2006. Требования (Requirements): Ясные и полные потребности или ожидания потребителей или лиц, представляющих их интересы (например, медицинских работников, служащих надзорных органов или законодателей). В данном документе тер- мин «требования» относится не только к требованиям закона, правовых или нормативных документов, но и указанные выше потребности или ожидания.
Риск (Risk): Комбинация вероятности нанесения вреда и тяжести этого вреда (Руководство ИСО/МЭК 51).
Допущение риска (Risk acceptance): решение о допустимости риска (Руководство ИСО/МЭК 73).
Анализ риска (Risk analysis): Оценка риска, связанная с данной опасностью.
Оценка риска (Risk assessment): Систематизированный процесс сбора информации для принятия решения в ходе анализа риска. Он включает в себя установление опасностей, анализ и оценку рисков, связанных этими опасностями.
Связь в процессе анализа рисков (Risk communication): Обмен информацией о риске и анализе риска между лицом, принимающим решение и другими сторонами.
Принятие мер по предупреждению риска (Risk control): Действия, направленные на реализацию решений по результатам анализа риска.
Оценка риска (Risk evaluation): Сравнение полученных данных о риске с за- данными критериями риска, используя количественные или качественные методы определения значимости риска.
Установление риска (Risk identification): Систематическое проведение анализа информации с целью обнаружения потенциальных источников ущерба (опасности) для данного вида риска или проблемы.
Работа в области рисков (Risk management): систематическое применение принципов обеспечения качества, инструкций и руководств для оценки, принятия мер, связи и пересмотра данных о риске.
Снижение риска (Risk reduction): Действия, направленные на снижение вероятности наступления ущерба и тяжести этого ущерба.
Пересмотр данных о риске (Risk review): пересмотр или контроль результатов работы в области рисков с учетом новых разработок (если они есть) и опыта в области анализа риска.
Тяжесть (Severity): Мера возможных последствий опасности.
Сторона (Stakeholder): лицо, группа лиц или организация, которая может влиять на риск, или быть подверженной влиянию его последствий. Лица, принимающие решения также могут являться сторонами. Для целей настоящего руководства первичными сторонами являются потребители, медицинские работники, над- зорные органы и предприятия.
Тенденция (Trend): статистический термин, относящийся к направлению и интенсивности изменений переменных величин.
Библиография
- ICH Q8 Pharmaceutical development;
- ISO/IEC Guide 73:2002 – Risk Management – Vocabulary – Guidelines for use in Standards;
- ISO/IEC Guide 51:1999 – Safety Aspects – Guideline for the inclusions in standards;
- Process Mapping by the American Productivity & Quality Center 2002, ISBN1928593739;
- IEC 61025 – Fault Tree Analysis (FTA);
- IEC 60812 Analysis Techniques for system reliability – Procedures for failure mode and effects analysis (FMEA);
- Failure Mode and Effect Analysis, FMEA from Theory to Execution, 2nd Edition 2003, D. H. Stamatis, ISBN 0873895983;
- Guidelines for Failure Modes and Effects Analysis (FMEA) for Medical Devices, 2003 Dyadem Press ISBN 0849319102;
- The Basis of FMEA, Robin McDermott, Raymond J. Mikulak, Michel R. Beaure- gard 1996 ISBN 0527763209;
- WHO Technical Report Series No 908, 2003 Annex 7 Application of Hazard Analysis and Critical Control Points (HACCP) methodology to pharmaceuticals;
- IEC 61882 – Hazard Operability Analysis (HAZOP);
- ISO 14971:2000 – Application of Risk Management to Medical Devices;
- ISO 7870:1993 – Control Charts;
- ISO 7871:1997 – Cumulative Sum Charts;
- ISO 7966:1993 – Acceptance Control Charts;
- ISO 8258:1991 – Shewhart Control Charts;
- What is Total Quality Control?; The Japanese Way, Kaoru Ishikawa (Translated by David J. Liu, 1985, ISBN 0139524339.
Приложение I. Методы анализа рисков
Данное приложение дает общий обзор и ссылки на некоторые методы, которые могут использоваться при анализе рисков предприятиями и надзорными органами. Использование ссылок позволяет получить более подробную информацию о рассматриваемых методах. Приводимые методы не являются исчерпывающими. Важно иметь в виду, что ни один метод или набор методов не является универсальным для анализа рисков.
I.1 Основные методы анализа рисков
К простым методам, обычно используемым систематизации данных, структурирования работы и облегчения принятия решений являются:
- диаграммы потоков,
- контрольные листы,
- карты процесса,
- диаграммы причин следствий, называемых также диаграммами Исикава или «рыбья кость».
I Анализ вида и влияния отказов (FMEA)
Метод анализа вида и влияния отказов (FMEA, IEC 60812) служит для оценки возможных причин отказов в процессах и их вероятного влияния на результат работы и/или продукт. После того, как установлен вид отказа, снижение риска может использоваться для устранения, ограничения, уменьшения или другого принятия мер в отношении отказов. FMEA основывается на знании продукта и процесса. FMEA дает методику разделения сложного процесса на приемлемые для анализа части. Он является эффективным средством для получения итоговой информации о существенных характеристиках отказов, причин этих отказов и возможных последствиях этих отказов.
Возможные области применения
FMEA может использоваться для установления градации рисков и контроля эффективности действий по их снижению.
FMEA может применяться к оборудованию и помещениям, анализу производственных операций и их влиянию на продукт или процесс. Он устанавливает эле- менты и операции внутри системы, которые делают ее уязвимой. Результаты FMEA могут использоваться в качестве основы для проектирования (конструирования), дальнейшего анализа или использоваться при дальнейшем развитии.
I.3 Анализа вида, влияния и критичности отказов
Область применения FMEA может расширена и включать изучение степени тяжести последствий отказов, вероятности их появления и возможности обнаружения. Метод, сочетающий эти особенности, называется методом анализа характера, влияния и критичности отказов (FMECA, IEC 60812). Для выполнения такого анализа необходимы спецификации (технические условия, технологический регламент) на продукт или процесс. FMECA позволяет определить точки, в которых требуется проведение предупредительных действий с целью сведения рисков к минимуму.
Возможные области применения
Применение FMECA в производстве лекарственных средств должно, главным образом, распространяться на отказы и риски, связанные с технологическими процессами, но это не ограничивает область применения этого метода. Результатом использования FMECA является присвоение количественного показателя (весового коэффициента) для каждого вида отказов, что позволяет ранжировать виды отказы с учетом их относительного риска.
I.4 Анализ дерева отказов
Метод анализа дерева отказов (FTA, IEC 61025) рассматривает отказы в работе продукта или процесса. Этот метод рассматривает отдельные отказы, но может использоваться и при сочетании многих причин отказов путем построения причинных цепей. Результаты анализа представляются наглядно для форме дерева видов отказов. На каждом уровне дерева дается описание видов отказов с использованием логических символов (и, или и пр.). FTA основывается на понимании процесса экспертами для установления причин отказов.
Возможные области применения
Метод FTA может использоваться для построения пути, ведущего к изначальной причине отказа. Он может использоваться для расследования рекламаций и отклонений для полного понимания их изначальной причины и обеспечения уверенности в том, что принимаемые меры полностью устранят эту причину и не приведут к другим последствиям (т. е решение одной проблемы не приведет к появлению новой). FTA является эффективным методом оценки влияния множественных факторов. К результатам работы по FTA относится и наглядное представление причин отказов. Оно полезно как для оценки рисков, так и для разработки программы контроля.
I.5 Анализ опасностей в критических контрольных точках
Метод анализа опасностей в критических контрольных точках (Hazard Analysis and Critical Control Points — HACCP) является систематизированным, направленным на предупреждение рисков методом для обеспечения качества, надежности и безопасности продукта (WHO Technical Report series No 908, 2003, Annex 7). Он является структурированным подходом, который использует принципы науки и техники для анализа, оценки, предупреждения и принятия мер в отношении риска или отрицательных последствий опасностей, вызванных проектом (конструкцией), разработкой, производством и использованием продукта.
Применение HACCP включает в себя следующие семь этапов:
- выполнение анализа опасностей и определение предупредительных мер для каждой операции процесса;
- определение критических контрольных точек;
- установление критических пределов;
- установление системы контроля в критических контрольных точках;
- определение корректирующих действий, которые следует предпринять, когда система контроля показывает, что параметры в критической точке вышли за установленные пределы;
- введение системы, которая подтверждает эффективность работы по НАССР;
- создание системы ведения документации.
Возможные области применения
Метод НАССР следует использовать анализа и принятия мер в отношении рисков, связанных с физической, химической или биологической опасностью включая микробное загрязнение. Этот метод наиболее эффективен, когда есть достаточно подробные данные о продукте или процессе, чтобы определить критические контрольные точки. Результатом анализа является информация о рисках, которая не только позволяет контролировать критические точки в процессе производства, но и на других этапах жизненного цикла.
I.6 Анализ опасностей для эксплуатации
Метод анализ опасностей для эксплуатации (Hazard Operability Analysis – HAZOP, IEC 61882) основан на предположении, что риском вызывается отклонениями от проекта (конструкции) или правил эксплуатации. Он является систематизированным методом мозгового штурма для установления опасностей с использованием ключевых слов (например: нет, более, иные чем, часть чего-то и пр.) в применении к определенным параметрам (например, загрязнение, температура) для облегчения установления потенциальных отклонений от нормальной эксплуатации или проекта (конструкции). Для работы по этому методу во многих случаях привлекаются группы специалистов, имеющие опыт в разработке процессов или продукции и их применении.
Возможные области применения
Метод HAZOP может применяться для производственных процессов, включая использование продукции и материалов, получаемых из внешних источников, а также поставщиков, оборудования и помещений, используемых для производства субстанций и готовых лекарственных средств. Он также использовался, в основном, в фармацевтической промышленности для оценки безопасности процессов. Так же и для НАССР, результатом работы по HAZOP является перечень критических операций для анализа рисков. Это позволяет организовать регулярный контроль в критических контрольных точках производственного процесса.
I.7 Предварительный анализ опасности
Метод предварительного анализа опасности (Preliminary Hazard Analysis — PHA) основан на использовании предшествующего опыта или информации об опасности или при невозможности установить будущие опасность, опасные ситуации и события, которые могут привести к ущербу или невозможности дать оценку их вероятности для данного вида деятельности, помещений, оборудования, продукта или системы.
Метод состоит в:
- установлении существования риска,
- количественной оценке возможного ущерба здоровью,
- относительного ранжирования опасности, используя комбинацию тяжести и вероятности нанесения ущерба,
- определение возможных способов устранения риска.
Возможные области применения
Метод PHA может применяться для систем и выделения приоритетов по опасностям, когда отсутствует возможность использования более информативных методов. Он может использоваться для оценки проекта помещений, конструкции оборудования и построения процессов, а так же для оценки видов опасностей исходя из характера производства, вида продукции и конкретных данных о продукте. Как правило, метод PHA применяется на ранних стадиях разработки проекта, когда подробная информация о проекте или технологических операциях отсутствует, т. е. метод дает предварительную проработку перед проведением дальнейших исследований. Как правило, опасности, обнаруженные с помощью метода PHA анализируются в дальнейшем другими методами, том числе рассмотренными ранее в настоящем приложении.
I.8 Ранжирование и отсеивание рисков
Метод ранжирования и отсеивания рисков (Risk ranking and filtering) используется для сравнения группирования рисков по их значимости (ранжирования). Ран- жирование рисков для сложной системы требует, как правило, анализа многих количественных и качественных факторов для каждого вида риска. Метод разделяет основной вопрос анализа рисков на столько элементов, сколько требуется для учета всех факторов, влияющих на риск. Эти факторы группируются в единую относи- тельную последовательность рисков, которая может использоваться для ранжирования. «Фильтры» в виде весовых коэффициентов или усеченных последовательностей, которые могут использоваться группирования или ранжирования рисков с целью проведения анализа или принятия решений.
Возможные области применения
Ранжирование рисков и их отсеивание при планировании проведения инспекций (аудита) производств надзорными органами или предприятиями. Методы ранжирования рисков дают наибольший эффект, когда полученная совокупность рисков и требующих учета факторов характеризуется разнообразием и трудностью анализа с использованием одного метода. Ранжирование рисков целесообразно, когда требуется как количественную, так и качественную характеристику рисков в рамках одной работы.
I.9 Вспомогательные статистические методы
Вспомогательные статистические методы (Supporting statistical tools) способствуют принятию решений в отношении рисков для качества. Они позволяют более эффективно выполнять оценку данных, значимости данных и более надежно принимать решения. Перечень наиболее часто применяемых статистических методов в фармацевтической промышленности включает в себя:
I Контрольные карты, например:
- Карты контроля приемлемости (ИСО 7966),
- Контрольные карты с средними арифметическими значениями и пределами предупреждения (ИСО 7873),
- Кумулятивные карты (ИСО 7871),
- Контрольные карты Шухарта (ИСО 8258),
- Скользящие средние, которым придается определенный вес; II Планирование эксперимента;
- Гистограммы;
- Диаграммы Парето;
- Анализ характеристик процесса.
Приложение II. Области применения методов анализа рисков
Данное приложение предназначено для ориентации работников промышленности и надзорных органов в выборе методов анализа рисков. Следует иметь в виду, что выбор метода полностью определяется конкретной задачей.
Приведенные примеры служат только для целей иллюстрации и служат только для информирования потенциальных пользователей.
II.1 Анализ рисков как часть системы обеспечения качества
Анализ рисков может использоваться в следующих случаях:
Документация:
- при пересмотре текущей документации и работе с нормативными документами;
- при определении предмета и содержания инструкций, руководств и пр.
Обучение и повышение квалификации:
- для оценки соответствия первоначального и повторного обучения образованию, опыту и практических навыков персонала, а также для периодической оценки обучения, в том числе его эффективности;
- для оценки способности персонала (его подготовки, опыта, квалификации и физических качеств) надежно выполнять порученную работу и не допускать отрицательного влияния на качество продукта.
Дефекты качества:
- для создания основы обнаружения и оценки влияния на качество различных дефектов, тенденций, отклонений, исследований, выхода параметров за пределы спецификаций, анализа рекламаций;
- для формирования связей по анализу рисков и разработки мер в отношении существенных дефектов продукции, контактов с надзорными органами и пр.
Проведение инспекций и аудитов
Для определения периодичности и объема аудитов (внешних и внутренних) следует учесть:
- Действующие нормативные и правовые документы,
- Общие данные о соответствии предприятия или производства установленным требованиям и историю предприятия;
- Эффективность работы по анализу рисков;
- Сложность производства;
- Сложность технологических процессов;
- Сложность продукции и ее терапевтической эффективности;
- Число и тяжесть дефектов качества;
- Результаты предыдущих инспекций/аудитов;
- Основные изменения в здании, оборудовании, процессах, ключевом персонале;
- Опыт производства продукта (например, частота выпуска серий продукта,их размер, число серий);
- Результаты испытаний, проводимых аккредитованными контрольными лабораториями.
Периодический анализ:
- для выбора, оценки и интерпретации результатов изучения тенденций при анализе качества продукта;
- для интерпретации данных контроля, например, для определения необходимости проведения повторной аттестации (валидации) или внесения изменений в методы отбора проб.
Планирование изменений и контроль изменений:
- для планирования изменений на основе информации, полученной в ходе производства и развития фармации;
- для оценки влияния изменений на готовый продукт;
- для оценки влияния изменений в помещениях, оборудовании, материалах, производственном процессе и внедрении новой техники;
- для определения действий, предшествующих внесению изменений, например, дополнительные испытания, повторная аттестация или взаимодействие с над- зорными органами.
Непрерывное совершенствование
Заключается в непрерывном совершенствовании процессов в течение жизненного цикла продукта.
II.2 Анализ рисков как часть работы надзорных органов
Анализ рисков может использоваться в следующих случаях:
Инспектирование и оценка соответствия:
- для определения необходимых ресурсов, например, при планировании инспекций, их периодичности и объема (см. раздел «Аудит» в приложении II.1;
- для оценки значимости, например, дефектов качества, возможных отзывов продукции и обнаруженных при проведении инспекции недостатков;
- для принятия решений по результатам проведения инспекции;
- для оценки данных, представляемых предприятиями, включая данные о развитии;
- для оценки влияния предложенных изменений;
- при определении факторов риска, в отношении которых должен быть обмен информацией между инспекцией и экспертами для лучшего понимания того, как риск может быть предупрежден (например, для выпуска продукции по параметрам, применении методов анализа процессов – Process Analytical Technology, PAT).
II.3 Анализ рисков как часть процесса развития
Анализ рисков может использоваться с целью:
- разработки продукта высокого качества и производственного процесса для обеспечения непрерывного соответствия продукта своему назначению;
- расширение знаний о характеристиках продукции с помощью различных показателей (например, распределением частиц по размерам, содержанием влаги, текучести), параметров технологического процесса и вариантах его реализации;
- оценки критических свойств исходных материалов, растворителей, активных фармацевтических субстанций, наполнителей и упаковочных материалов;
- разработки спецификаций, в которых указываются критические параметры процесса и устанавливается порядок контроля при производстве (например, с использованием данных о разработке продукта в плане значимости показателей качества для клинической эффективности продукта и возможности их контроля при производстве);
- уменьшения разброса свойств качества:
- сокращения дефектов продукта и материалов;
- сокращения дефектов в производстве;
- оценки необходимости дальнейшего анализа (например, биоэквивалентности, стабильности) с учетом расширения производства и внедрения новых технологий;
- использования принципа «проектируемого пространства» — “design space” (ICH Q8).
II.4 Анализ рисков помещений, оборудования, технологических сред и инженерных сетей
Анализ рисков может использоваться в следующих случаях:
Проект (конструкция) помещений и оборудования:
- для выделения необходимых при проектировании зданий и помещений с учетом:
- потоков материалов и персонала,
- минимизации загрязнений,
- борьбы с насекомыми,
- предотвращения перепутывания,
- использования открытых и закрытых систем,
- чистых помещений и изоляторов,
- специализированных или изолированных (отделенных) помещений и оборудования;
- для определения вида материалов оборудования, вступающих в контакт с продуктом и первичной упаковкой,
- для определения необходимых технологических сред и инженерных сетей (например, пар, газы, вода, сжатый воздух, источники энергии, системы отопления, вентиляции и кондиционирования);
- планирование предупредительного технического обслуживания оборудования, например, инвентаризации запасных частей.
Чистота оборудования:
- для защиты продукта от влияния внешних факторов, включая химические, микробиологические и физические загрязнения (опасности), например, разработка требований к одежде, порядку переодевания, гигиене);
- для защиты окружающей среды (например, персонала, объектов, чувствительных к перекрестным загрязнениям) от опасностей, связанных с производством данного продукта.
Аттестация помещений, оборудования, технологических сред и инженерных сетей:
Выполняется для определения рамок и объема работ по аттестации помещений, зданий, производственного оборудования и/или лабораторных приборов, включая поверку (калибровку).
Очистка оборудования и контроль окружающей среды:
- для разделения действий и решений, основываясь на показателях назначения оборудования (например, универсальное и специализированное, производство сериями и непрерывное производство);
- для определения пределов приемлемости (заданных пределов) при аттестации процессов очистки.
Поверка (калибровка) и техническое обслуживание
Используется при разработке графиков поверки (калибровки) и технического обслуживания.
Компьютерные системы и компьютерное контрольное оборудование:
- для выбора компьютера и программного обеспечения (модульное, структурированное, устойчивое к отказам);
- для определения продолжительности и содержания аттестации (валидации), например:
- установление критических параметров,
- задания требований и выбора конструкции,
- пересмотр системы кодирования;
- длительность испытаний и выбор методов испытаний;
- надежностей электронных записей и электронных кодов.
II.5 Анализ рисков как часть работы с материалами
Анализ рисков может использоваться в следующих случаях:
Анализ и оценка поставщиков и исполнителей, работающих по контракту:
Выполняется для обеспечения полноты информации и обоснованности оценки поставщиков и исполнителей, работающих по контракту (например, проведение аудитов, заключение соглашений с поставщиками об обеспечении качества).
Исходные материалы:
Выполняется для оценки различий и возможных рисков для качества, связанных с разбросом характеристик исходных материалов (например, за счет старения, методов синтеза).
Использование материалов:
Выполняется для:
- определения возможности использования материала, находящегося в карантинном хранении (например, в данном производстве);
- определения пригодности к переработке и использования возвращенных материалов.
Хранение, работа складов и условия распределения:
Выполняется для:
- оценки соответствия условий хранения и транспортирования (например, температуры, влажности, конструкции упаковки) заданным требованиям;
- определения влияния нарушений в хранении или транспортировании (например, при организации холодовой цепи) с учетом руководств ICH;
- поддержания инфраструктуры (например, способности обеспечивать требования к отгрузке, промежуточного хранения, обращения с опасными материалами и требующими контроля субстанциями, таможенной очистке);
- обеспечения информацией в отношении доступности лекарственных средств, например, с использованием ранжирования рисков в цепи поставки).
II.6 Анализ рисков как часть производства
Анализ рисков может использоваться в следующих случаях:
Аттестация (испытания):
Выполняется для:
- установления пределов (рамок) и объема аттестации (например, аналитических методов, процессов, оборудования, методов очистки);
- определения объема последующих действий (например, отбора проб, контроля, повторной аттестации);
- установления различий между критическими и некритическими этапами процесса для проведения исследований при аттестации (валидации).
Внутрипроизводственный отбор проб и контроль
Выполняется для:
- определения периодичности и объема выполнения внутрипроизводственного контроля (например, обоснования сниженного объема контроля определенных условиях);
- оценки и обоснования использования методов анализа процессов в сочетании с выпуском продукции по параметрам и в реальном времени.
Планирование производства
Предусматривает соответствующие методы планирования (например, выделение производства, производство кампаниями или совпадающими последовательностями производства).
II.7 Анализ рисков как часть лабораторного контроля и контроля ста- бильности
Анализ рисков может использоваться в следующих случаях:
Выхода за пределы спецификаций
Выполняется для установления возможных исходных причин и разработки корректирующих действий при анализе случаев выхода за пределы спецификаций.
Контроля периодичности повторных испытаний и срока годности
Выполняется для оценки правильности хранения и испытаний исходных мате- риалов, наполнителей и промежуточной продукции.
II.8 Анализ рисков как часть процессов упаковки и маркировки
Анализ рисков может использоваться для:
Конструкции упаковки
Выполняется для конструирования вторичной упаковки с целью защиты продукта в первичной упаковке (например, для того, чтобы удостовериться в подлинности продукта, читаемости маркировки).
Выбор системы укупоривания
Выполняется для определения критических параметров системы укупоривания контейнеров (первичной упаковки).
Контроль маркировки
Выполняется при разработке инструкций по контролю, основываясь на возможности перепутывания из-за неправильного нанесения маркировки или из-за не- правильных вариантов одной и той же маркировки.

